Podczas II Ogólnopolskiej Mikrobiologicznej Konferencji Naukowej Microbs, która odbyła się w Dwikozach k. Sandomierza (18-19 maja 2017 r.), zaprezentowano wyniki badań, ocenę zdolności tworzenia biofilmu przez bakterie Pseudomonas aeruginosa (pałeczka ropy błękitnej) i Staphylococcus aureus (Gronkowiec złocisty) izolowane od chorych na mukowiscydozę.
Badania prowadziły Sylwia Jarzynka, Anna Minkiewicz, Gabriela Olędzka, Kamila Strom (Zakład Biologii Medycznej, Warszawski Uniwersytet Medyczny) oraz Agnieszka Iwańska, Ewa Augustynowicz-Kopeć (Zakład Mikrobiologii, Instytut Gruźlicy i Chorób Płuc w Warszawie).
Celem badań była ocena zdolności tworzenia biofilmu przez bakterie Pseudomonas aeruginosa i Staphylococcus aureus izolowane od chorych na mukowiscydozę.
Biofilm to wysoce zorganizowana, wielowarstwowa struktura, zbudowana z komórek jednego bądź wielu gatunków drobnoustrojów. Formowanie się matrycy biofilmu ma na celu ochronę mikroorganizmów (tworzących biofilm) przed degradacyjną działalnością czynników środowiskowych, w tym na działanie antybiotyków. Biofilm ma udział w patogenezie chorób przewlekłych, zwłaszcza zakażeń towarzyszących stosowaniu cewników, drenów, zakładaniu implantów. Stanowi poważny problem w zakażeniach wewnątrzszpitalnych. Złożona struktura biofilmu i odmienne cechy fizjologiczne drobnoustrojów go tworzących, tłumaczą po części ich wysoką oporność na działanie różnych czynników bakteriobójczych, w tym oporność na antybiotyki. Przykładem choroby w przebiegu której biofilm bakteryjny wydaje się odgrywać znaczącą rolę jest zapalenie płuc u pacjentów z mukowiscydozą.
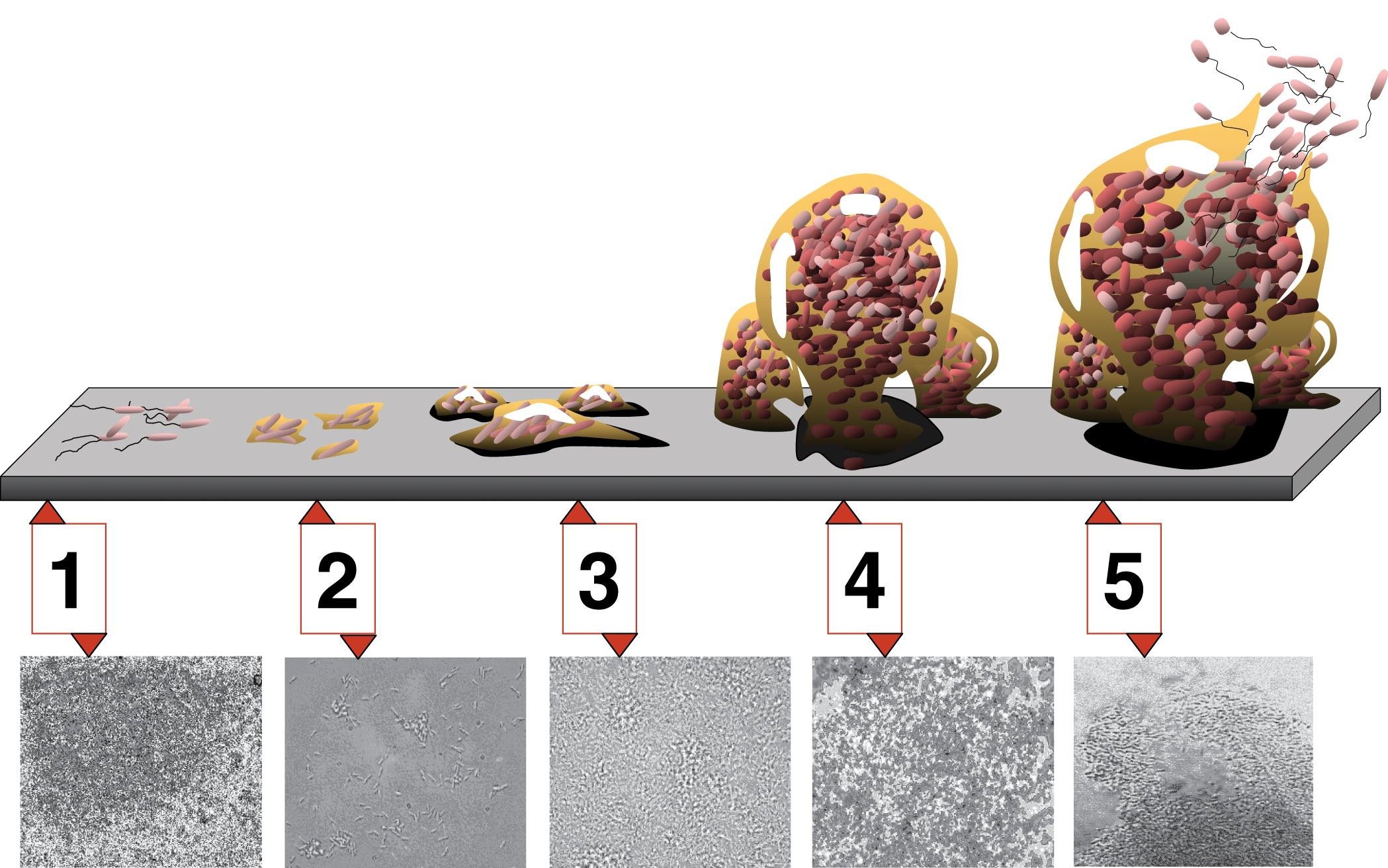
5 etapów powstawania biofilmu. 1. początkowe przywiązanie; 2. nieodwracalne przywiązanie; 3. dojrzewanie I; 4. dojrzewanie II; 5. rozproszenie. Każdemu etapowi powstawania biofilmu na schemacie odpowiada mikrofotografia powstającego biofilmu P. aeruginosa. Wszystkie mikrofotografie są przedstawione w tej samej skali.
Przebadano 50 szczepów P. aeruginosa oraz 33 szczepy S. aureus, izolowane z próbek plwociny i wydzielin oskrzelowych od 50 wybranych chorych z mukowiscydozą (>18r.ż), leczonych w Instytucie Gruźlicy i Chorób Płuc w 2016r.
Biofilm analizowano metodą barwienia z użyciem fioletu krystalicznego. Klasyfikację szczepów ze względu na zdolność do tworzenia biofilmu (mały, średni, duży), dokonano na podstawie odczytu absorbancji mierzonej spektrofotometrycznie po 24, 48 i 72 godz. inkubacji.
Wśród pałeczek ropy błękitnej wykazano fenotypy śluzowe (20 szczepy) i nieśluzowe (30 szczepy). Po 48 godz. inkubacji oznaczono najwyższą zdolność S. aureus do formowania struktury biofilmu, a po 72 godz. dla pałeczki ropy błękitnej. Duży potencjał formowania biofilmu oznaczono dla 20 izolatów S. aureus oraz 10 P. aeruginosa. 5 szczepów S. aureus i 34 P. aeruginosa cechowała mała zdolność tworzenia biofilmu.
Wszystkie z analizowanych szczepów S. aureus i P. aeruginosa były w stanie tworzyć biofilm w warunkach in vitro jednak z różną intensywnością. Fenotypy nieśluzowe P. aeruginosa wykazywały większą zdolność wzrostu w postaci biofilmu. Szczepy S. aureus, wykazywały wysoki potencjał tworzenia biofilmu w krótkim okresie inkubacji.
Badania i ich wyniki posłużą dokładniejszemu poznaniu struktury biofilmu. Mogę być również pomocne w opracowywaniu nowych metod walki z bakteriami tworzącymi biofilm w płucach osób chorych na mukowiscydozę.
W artykule wykorzystano fragmenty posteru oraz wyniki badań “Ocena zdolności tworzenia biofilmu przez Pseudomonas aeruginosa i Staphylococcus aureus
izolowane od chorych na mukowiscydozę”- Sylwia Jarzynka, Anna Minkiewicz, Gabriela Olędzka, Kamila Strom (Zakład Biologii Medycznej, Warszawski Uniwersytet Medyczny) oraz Agnieszka Iwańska, Ewa Augustynowicz-Kopeć (Zakład Mikrobiologii, Instytut Gruźlicy i Chorób Płuc w Warszawie).
fot.1 Biofilm na powierzchni medycznego cewnika (złożony z bakterii Staphylococcus aureus)
fot.2 D. Davis. D. Monroe. “Looking for Chinks in the Armor of Bacterial Biofilms”. PLoS Biology 5 (11, e307). DOI:10.1371/journal.pbio.005030 Creative Commons Attribution 2.5 Generic

