Odpowiedź Ministerstwa Zdrowia w sprawie interpelacji posła Eugeniusza Czykwina

Publikujemy odpowiedź Ministerstwa Zdrowia w sprawie interpelacji posła Eugeniusza Czykwina nt. leków stosowanych w mukowiscydozie.
Treść odpowiedzi:
Szanowna Pani Marszałek,
w odpowiedzi na interpelację nr 324, Pana Eugeniusza Czykwina, Posła na Sejm Rzeczypospolitej Polskiej, przekazaną do Ministerstwa Zdrowia 11 grudnia 2019 r., Minister Zdrowia prosi o przyjęcie poniższych informacji.
Wszelkie kwestie związane z refundacją reguluje ustawa z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych (Dz.U. z 2019 r. poz. 784, z późn. zm.), zwana dalej „ustawą refundacyjną”.
Uprzejmie informuję, iż w obowiązującym stanie prawnym, zgodnie z zapisami powyższej ustawy, objęcie refundacją produktu leczniczego bądź zmiana warunków refundacji (w tym zmiana cen, wskazań, zapisów programów lekowych) jest dokonywana w drodze decyzji administracyjnej wydawanej przez Ministra Zdrowia w oparciu o wniosek przedłożony przez podmiot odpowiedzialny (producenta leku, jego przedstawiciela lub importera). Decyzja refundacyjna jest wydawana na 2 lub 3 lata, zgodnie z zapisami art. 11 ustawy refundacyjnej.
Mając na uwadze powyższe, aby Tobramycyna mogła być dostępna poza programem lekowym niezbędne jest złożenie odpowiedniego wniosku przez podmiot odpowiedzialny.
Objęcie refundacją antybiotyków nowej generacji również wymaga złożenia wniosku przez podmiot odpowiedzialny. Każdy wniosek dla leku z substancją wcześniej nierefundowaną musi zostać oceniony przez Agencję Oceny Technologii Medycznych i Taryfikacji, a w kolejnym etapie przekazywany jest do Komisji Ekonomicznej, która prowadzi z wnioskodawcą negocjacje w zakresie ustalenia urzędowej ceny zbytu, poziomu odpłatności oraz wskazań, w których lek ma być refundowany. Dopiero dysponując rekomendacją Prezesa Agencji oraz stanowiskiem Komisji Ekonomicznej, uwzględniając kryteria ujęte w art. 12 wspomnianej ustawy, Minister Zdrowia podejmie decyzję o objęciu, bądź odmowie objęcia refundacją leku we wnioskowanym wskazaniu.
Art. 12 ustawy refundacyjnej określa kryteria jako:
1) stanowisko Komisji Ekonomicznej,
2) rekomendację Prezesa Agencji,
3) istotność stanu klinicznego, którego dotyczy wniosek o objęcie refundacją,
4) skuteczność kliniczną i praktyczną,
5) bezpieczeństwo stosowania,
6) relację korzyści zdrowotnych do ryzyka stosowania,
7) stosunek kosztów do uzyskiwanych efektów zdrowotnych dotychczas refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, w porównaniu z wnioskowanym,
8) konkurencyjność cenową,
9) wpływ na wydatki podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych i świadczeniobiorców,
10) istnienie alternatywnej technologii medycznej, w rozumieniu ustawy o świadczeniach, oraz jej efektywności klinicznej i bezpieczeństwa stosowania,
11) wiarygodność i precyzję oszacowań kryteriów, o których mowa w pkt 3-10,
12) priorytety zdrowotne określone w przepisach wydanych na podstawie art. 31 a ust. 2 ustawy o świadczeniach,
13) wysokość progu kosztu uzyskania dodatkowego roku życia skorygowanego o jakość, ustalonego w wysokości trzykrotności Produktu Krajowego Brutto na jednego mieszkańca, o którym mowa w art. 6 ust. 1 ustawy z dnia 26 października 2000 r. o sposobie obliczania wartości rocznego produktu krajowego brutto (Dz. U. poz. 1188 oraz z 2009 r. poz. 817), a w przypadku braku możliwości wyznaczenia tego kosztu – koszt uzyskania dodatkowego roku życia – biorąc pod uwagę inne możliwe do zastosowania w danym stanie klinicznym procedury medyczne, które mogą być zastąpione przez wnioskowany lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny.
Ministerstwo Zdrowia dysponuje informacjami w zakresie produktów farmaceutycznych refundowanych w innych krajach oraz o ich cenach. Jednym ze źródeł tych informacji jest platforma EURIPID.
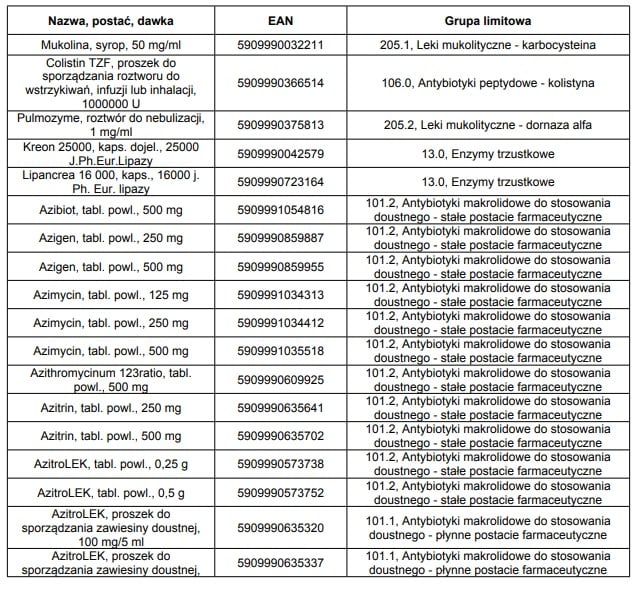
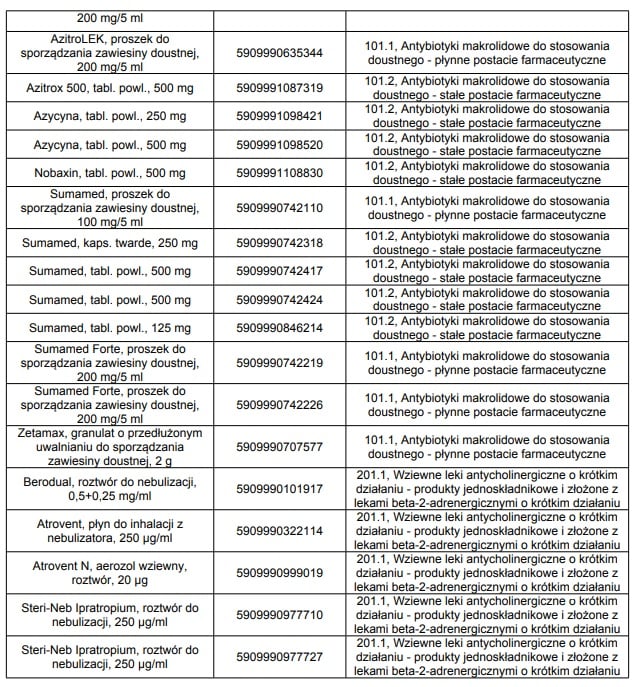
W styczniu 2015 roku we wskazaniu mukowiscydoza, refundowane było 36 następujących leków:
W obwieszczeniu na 1 stycznia 2016 r. we wskazaniu mukowiscydoza objęte refundacją zostały kolejne odpowiedniki leków już refundowanych, np.: Azithromycin Actavis, tabl. powl., 500 mg; AzitroLEK 250, tabl. powl., 250 mg; AzitroLEK 500, tabl. powl., 500 mg; Azycyna, granulat do sporządzania zawiesiny doustnej, 200 mg/5 ml; Azithromycin Genoptim, tabl. powl., 500 mg; a także preparat Proursan, kaps., 250 mg. W roku 2017 objęty refundacja został Atrodil, aerozol inhalacyjny, roztwór, 20 µg. Azytact, tabl. powl. oraz 500 mg, Canbiox, tabl. powl., 500 mg zostały objęte refundacja w roku 2018. W 2019 r. na listę leków refundowanych dodano 2019 r. Macromax, tabletki powlekane, 500 mg.
Powyższe dane przedstawiają stan na poszczególne lata z obwieszczeń Ministra Zdrowia w sprawie wykazu refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych na 1 styczeń.
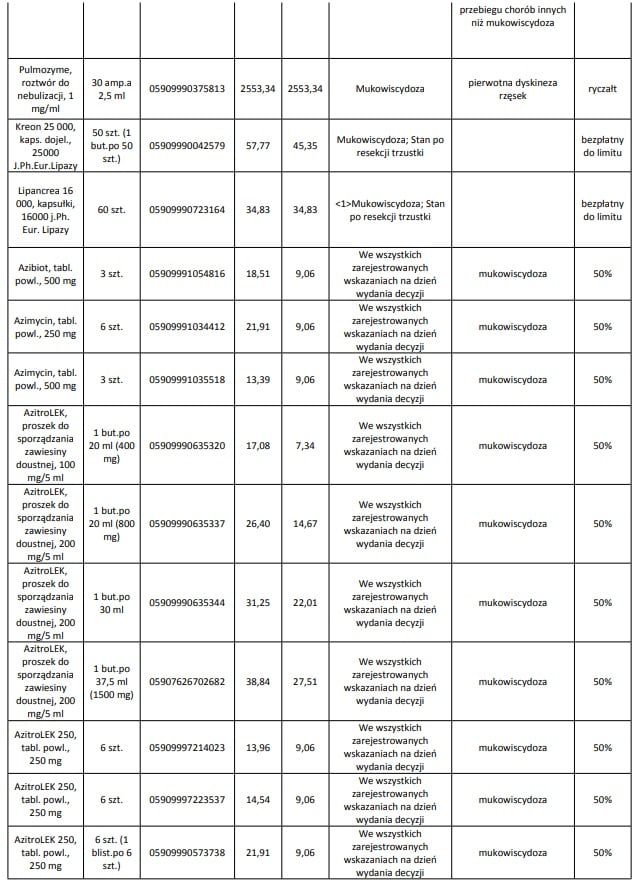
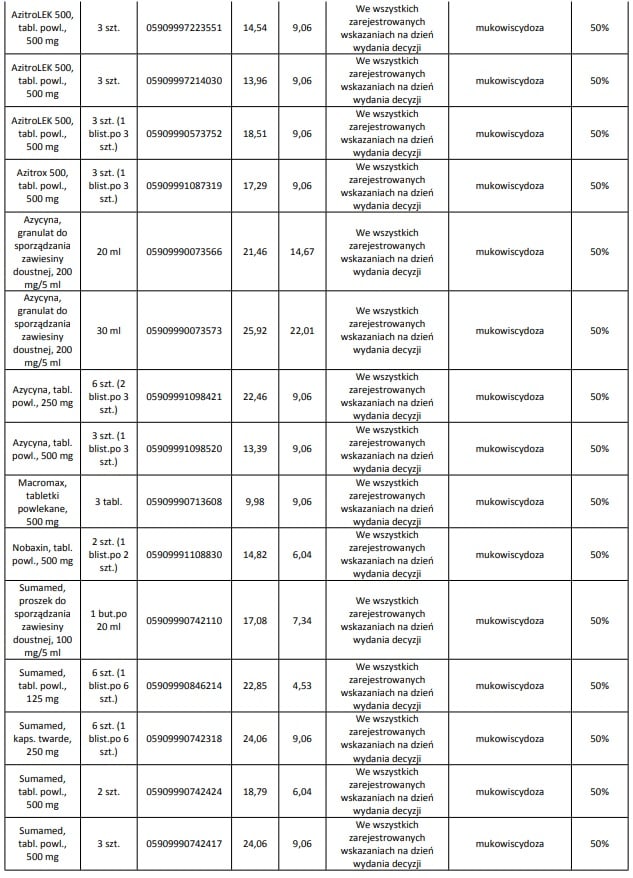
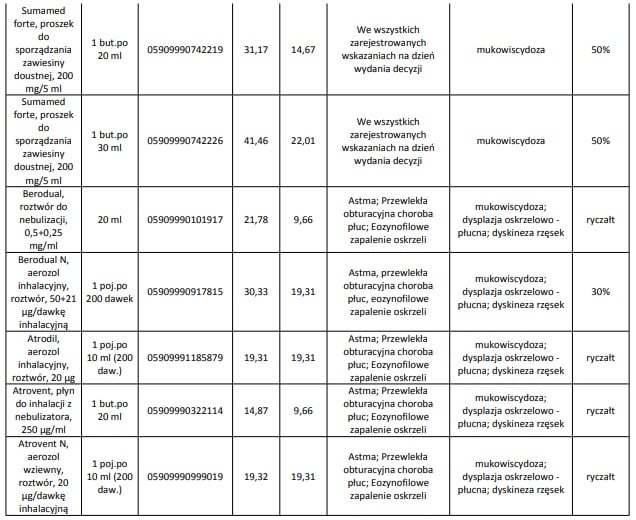
Obecnie we wskazaniu mukowiscydoza refundowane są następujące leki:
W tym miejscu pragnę zapewnić, iż resort zdrowia przykłada bardzo dużo uwagi do problemu osób chorych na mukowiscydozę. Działając w ramach obowiązujących przepisów oraz starannie równoważąc interesy wszystkich grup pacjentów, a także mając na względzie obowiązek dbania o dyscyplinę finansów publicznych, podejmowane są wielokierunkowe działania celem zapewnienia kompleksowej opieki pacjentom.
Dla pacjentów został również przygotowany program lekowy: B.27. – Leczenie przewlekłych zakażeń płuc u świadczeniobiorców z mukowiscydozą. Aby zakwalifikować się do wyżej wymienionego programu i móc skorzystać z bezpłatnego leczenia należy spełnić następujące kryteria:
- wiek od 6 lat,
- udokumentowane przewlekłe zakażenie płuc wywołanym przez Pseudomonas aeruginosa,
- oporność na kolistynę lub udokumentowana nietolerancja kolistyny (nietolerancję kolistyny można wykazać poprzez spadek FEV1 lub FVC po rozpoczęciu leczenia kolistyną podawaną wziewnie lub dodatni wynik testu degranulacji bazofilów z kolistyną).
Dodatkowo refundacją objęte są 4 różne środki spożywcze specjalnego przeznaczenia żywieniowego stosowane w diecie pacjentów chorych na mukowiscydozę (za najtańsze pacjent zapłaci 3,20 zł).
Uprzejmie informuję, iż w ramach programu polityki zdrowotnej pn. Program badań przesiewowych noworodków w Polsce (obecnie realizowana kolejna edycja Programu na lata 2019-2022) od czerwca 2009 roku wszystkie dzieci urodzone w Polsce są objęte w pierwszych dobach życia badaniem, którego celem jest wykrycie mukowiscydozy. Należy wskazać, iż badanie przesiewowe noworodków jest bardzo ważnym postępowaniem profilaktycznym, które polega na wstępnej identyfikacji chorób wrodzonych, za pomocą testów analitycznych, przed wystąpieniem objawów klinicznych. W ramach poprzedniej edycji Programu, w latach 2015-2018 na badania przesiewowe w kierunku mukowiscydozy przeznaczono środki w wysokości 16 733 128,00 zł (z czego 4 518 105,00 zł w roku 2018). W powyższym okresie wykryto łącznie 400 przypadków (z czego 94 w roku 2018) tej choroby, co z kolei umożliwiło podjęcie odpowiedniego leczenia i zwiększenia szansy przeżycia chorego dziecka przez znaczne złagodzenie przebiegu choroby.
Należy wskazać, iż w ramach powyższego Programu prowadzone są również działania zmierzające do podniesienia świadomości społeczeństwa na temat znaczenia badań przesiewowych, a także chorób wrodzonych – w tym mukowiscydozy. Realizator Programu – Instytut Matki i Dziecka w Warszawie, w ramach zawartych umów z Ministerstwem Zdrowia prowadzi stronę internetową na temat prowadzonych badań przesiewowych (http://przesiew.imid.med.pl/index.html) oraz odpowiada za produkcję oraz dystrybucję ulotek i plakatów skierowanych do rodziców, które są rozdystrybuowane na oddziałach położniczych w szpitalach w całej Polsce. Należy zaznaczyć, iż w Polsce – podobnie jak we wszystkich krajach – priorytetem systemu opieki zdrowotnej jest sprawiedliwe społecznie gospodarowanie publicznymi środkami przeznaczonymi na finansowanie świadczeń zdrowotnych. Ustawa o refundacji nakłada na ministra właściwego ds. zdrowia obowiązek gospodarowania
środkami pochodzącymi ze składek obywateli w sposób racjonalny, tj. zapewniający wszystkim obywatelom mającym zróżnicowane potrzeby zdrowotne sprawiedliwy dostęp do skutecznych terapii. Podstawą tak rozumianej sprawiedliwości społecznej jest podejmowanie decyzji dotyczących alokacji publicznych zasobów systemowych w oparciu o jednolite, powtarzalne i przejrzyste kryteria stosowania wobec zróżnicowanych potrzeb zdrowotnych wielu grup pacjentów.
Przedstawiając powyższe uprzejmie informuję, że odpowiedź w zakresie pozostałych pytań zostanie dodatkowo uzupełniona po uzyskaniu niezbędnych danych.
Z poważaniem
z upoważnienia Ministra Zdrowia
Maciej Miłkowski
Podsekretarz Stanu