Odpowiedź Ministerstwa Zdrowia w sprawie interpelacji posłanki Anny Schmidt-Rodziewicz

Publikujemy odpowiedź Ministerstwa Zdrowia w sprawie interpelacji posłanki Anny Schmidt-Rodziewicz nt. leków przyczynowych w mukowiscydozie.
Treść odpowiedzi:
Szanowna Pani Marszałek,
w odpowiedzi na interpelację nr 927, Pani Anny Schmidt-Rodziewicz, Posła na Sejm Rzeczypospolitej Polskiej, przekazaną do Ministerstwa Zdrowia 23 grudnia 2019 r., uprzejmie proszę o przyjęcie poniższych informacji.
Wszelkie kwestie związane z refundacją reguluje ustawa z dnia 12 maja 2011 r. o refundacji leków, środków spożywczych specjalnego przeznaczenia żywieniowego oraz wyrobów medycznych (Dz.U. z 2019 r. poz. 784, z późn. zm.), zwana dalej „ustawą refundacyjną”.
Uprzejmie informuję, iż w obowiązującym stanie prawnym, zgodnie z zapisami powyższej ustawy, objęcie refundacją produktu leczniczego bądź zmiana warunków refundacji (w tym zmiana cen, wskazań, zapisów programów lekowych) jest dokonywana w drodze decyzji administracyjnej wydawanej przez Ministra Zdrowia w oparciu o wniosek przedłożony przez podmiot odpowiedzialny (producenta leku, jego przedstawiciela lub importera). Decyzja refundacyjna jest wydawana na 2 lub 3 lata, zgodnie z zapisami art. 11 ustawy refundacyjnej.
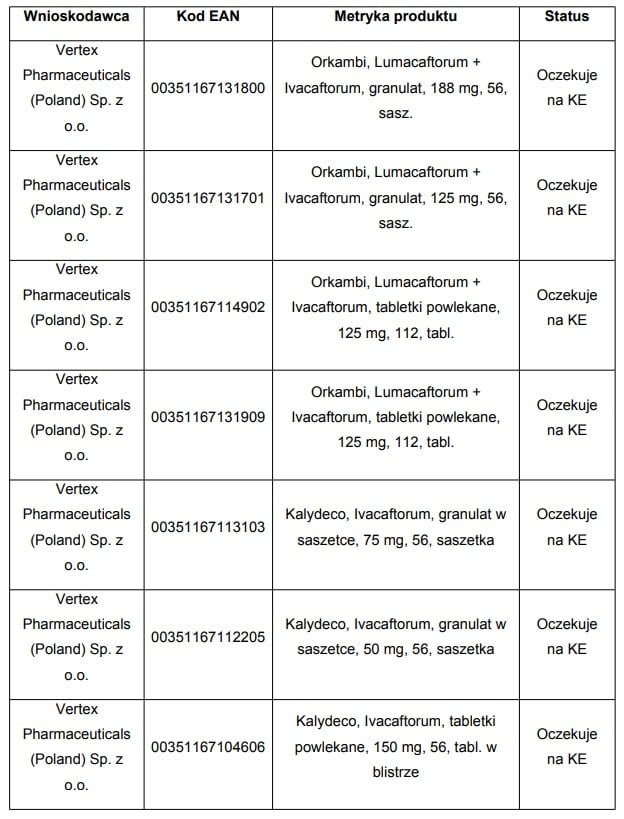
Do Ministra Zdrowia wpłynęły wnioski o objęcie refundacją i ustalenie urzędowej ceny zbytu dwóch leków przyczynowych w leczeniu mukowiscydozy: Orkambi oraz Kalydeco.
W przypadku nowych, dotychczas nieobecnych w wykazie refundacyjnym substancji czynnych lub wskazań refundacyjnych Agencja Oceny Technologii Medycznych i Taryfikacji dokonuje oceny tego przedmiotowego wniosku. AOTMiT w swojej ocenie dokonuje weryfikacji analizy klinicznej, w której zawarta jest synteza danych w zakresie skuteczności oraz ocena bezpieczeństwa. Dodatkowo AOTMiT weryfikuje również analizę ekonomiczną i analizę wpływu na budżet podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych.
W kolejnym etapie postępowania całość dokumentacji przekazywana jest Komisji Ekonomicznej, która prowadzi z wnioskodawcą negocjacje w zakresie ustalenia urzędowej ceny zbytu, poziomu odpłatności oraz wskazania, w którym wnioskowany produkt ma być refundowany. Dopiero dysponując rekomendacją Prezesa Agencji oraz stanowiskiem Komisji Ekonomicznej, uwzględniając kryteria ujęte w art. 12 wymienionej na wstępie ustawy, Minister Zdrowia podejmuje decyzję o objęciu, bądź odmowie objęcia refundacją procedowanego produktu we wnioskowanym wskazaniu.
Z powyższego wynika zatem, iż objęcie leku refundacją wymaga przeprowadzenia wieloetapowego postępowania administracyjnego.
Minister Zdrowia rozpatrując wnioski refundacyjne wydaje decyzję o objęciu lub odmowie objęcia refundacją technologii medycznej biorąc pod uwagę wszystkie kryteria określone przepisami ustawy o refundacji (art. 12 ustawy refundacyjnej), tj.
- stanowiska Komisji Ekonomicznej, o której mowa w art. 17,
- rekomendacji Prezesa Agencji, o której mowa w art. 35 ust. 6,
- istotności stanu klinicznego, którego dotyczy wniosek o objęcie refundacją,
- skuteczności klinicznej i praktycznej,
- bezpieczeństwa stosowania,
- relacji korzyści zdrowotnych do ryzyka stosowania,
- stosunku kosztów do uzyskiwanych efektów zdrowotnych dotychczas refundowanych leków, środków spożywczych specjalnego przeznaczenia żywieniowego, wyrobów medycznych, w porównaniu z wnioskowanym,
- konkurencyjności cenowej,
- wpływu na wydatki podmiotu zobowiązanego do finansowania świadczeń ze środków publicznych i świadczeniobiorców,
- istnienia alternatywnej technologii medycznej, w rozumieniu ustawy o świadczeniach, oraz jej efektywności klinicznej i bezpieczeństwa stosowania,
- wiarygodności i precyzji oszacowań kryteriów, o których mowa w pkt 3-10,
- priorytetów zdrowotnych określonych w przepisach wydanych na podstawie art. 31 a ust. 2 ustawy o świadczeniach, wysokości progu kosztu uzyskania dodatkowego roku życia skorygowanego o jakość, ustalonego w wysokości trzykrotności Produktu Krajowego Brutto na jednego mieszkańca, o którym mowa w art. 6 ust. 1 ustawy z dnia 26 października 2000 r. o sposobie obliczania wartości rocznego produktu krajowego brutto (Dz. U. poz. 1188 oraz z 2009 r. poz. 817), a w przypadku braku możliwości wyznaczenia tego kosztu – koszt uzyskania dodatkowego roku życia
– biorąc pod uwagę inne możliwe do zastosowania w danym stanie klinicznym procedury medyczne, które mogą być zastąpione przez wnioskowany lek, środek spożywczy specjalnego przeznaczenia żywieniowego, wyrób medyczny.
Należy zaznaczyć, iż w Polsce – podobnie jak we wszystkich krajach – priorytetem systemu opieki zdrowotnej jest sprawiedliwe społecznie gospodarowanie publicznymi środkami przeznaczonymi na finansowanie świadczeń zdrowotnych. Ustawa o refundacji nakłada na ministra właściwego ds. zdrowia obowiązek gospodarowania środkami pochodzącymi ze składek obywateli w sposób racjonalny, tj. zapewniający wszystkim obywatelom mającym zróżnicowane potrzeby zdrowotne sprawiedliwy dostęp do skutecznych terapii. Podstawą tak rozumianej sprawiedliwości społecznej jest podejmowanie decyzji dotyczących alokacji publicznych zasobów systemowych w oparciu o jednolite, powtarzalne i przejrzyste kryteria stosowania wobec zróżnicowanych potrzeb zdrowotnych wielu grup pacjentów.
Niemniej już teraz Minister Zdrowia podejmując rozstrzygnięcie bierze pod uwagę fakt, czy lek należy do grupy leków sierocych. Niestety w większości przypadków ceny leków sierocych są tak duże, że włączenie tych leków do refundacji zagraża budżetowi refundacyjnemu.
Minister Zdrowia biorąc pod uwagę wszystkie kryteria wymienione w art. 12 ustawy refundacyjnej oraz dobro wszystkich pacjentów włącza sukcesywnie leki sieroce do wykazu leków refundowanych. Przykładem może być włączony do refundacji wyjątkowo drogi lek zawierający nusinersen stosowany u pacjentów cierpiących z powodu rdzeniowego zaniku mięśni.
Podsumowując należy wskazać, że rozstrzygnięcia w takich sprawach są podejmowane ze szczególną rozwagą i ostrożnością.
z upoważnienia Ministra Zdrowia
Maciej Miłkowski
Podsekretarz Stanu